近日,中國科學院大連化學物理研究所蛋白質(zhì)折疊化學生物學創(chuàng)新特區(qū)研究組研究員劉宇團隊,與山東大學教授劉曉靜、中科院生物物理所研究員王磊、大連醫(yī)科大學第二附屬醫(yī)院教授高振明合作,通過發(fā)展對蛋白質(zhì)錯誤折疊與聚集敏感的溶劑致變色熒光探針,定量測量了胞內(nèi)多種致病蛋白質(zhì)的內(nèi)部極性微環(huán)境。該工作揭示了聚集態(tài)蛋白質(zhì)在微結(jié)構(gòu)與種類上的極性差異性,并建立了蛋白質(zhì)聚集態(tài)極性與其致病能力的相關(guān)性。
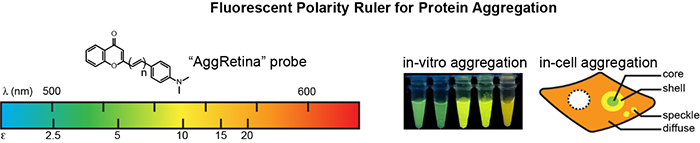
蛋白質(zhì)聚集的熒光極性標尺
細胞內(nèi)蛋白質(zhì)的錯誤折疊與聚集會引發(fā)多種蛋白質(zhì)構(gòu)型疾病,如阿爾茲海默癥、帕金森癥、漸凍人癥和心肌淀粉樣變等。早期針對聚集態(tài)蛋白質(zhì)的研究通常聚焦于其聚集態(tài)形貌與聚集過程的生化機理。然而,針對其本身物理和化學性質(zhì)(如極性、粘稠度、氧化還原性質(zhì)、酸堿度、化學反應性等)的定量信息相對匱乏。此外,近期多項研究顯示,聚集態(tài)蛋白質(zhì)的這些理化性質(zhì)與其致病機制有著密切關(guān)系。
課題組在前期多種聚集態(tài)蛋白質(zhì)探針(Anal. Chem.,2021;Angew. Chem. Int. Ed.,2021;Angew. Chem. Int. Ed.,2021;Chem. Sci.,2021)的研究基礎(chǔ)上,進一步發(fā)展了一類同時具有對極性微環(huán)境和聚集態(tài)蛋白質(zhì)敏感度的熒光探針(AggRetina)。該類探針可選擇性結(jié)合聚集態(tài)蛋白質(zhì),并根據(jù)其內(nèi)部極性微環(huán)境的不同發(fā)出不同波長的熒光。利用所構(gòu)建的波長與極性的線性關(guān)系,可定量測量不同蛋白質(zhì)聚集態(tài)的極性差異性。更重要的是,這種極性差異性與其蛋白酶解速率密切相關(guān),從分析化學的角度側(cè)面闡釋了其致病性。通過活細胞熒光成像,該探針在胞內(nèi)觀察到致病蛋白質(zhì)所形成的聚集體具有結(jié)構(gòu)上的異質(zhì)性。該工作為后期進一步通過蛋白質(zhì)組學分析聚集態(tài)蛋白質(zhì)組提供了新的研究方向。
上述成果以“A Solvatochromic Fluorescent Probe Reveals Polarity Heterogeneity upon Protein Aggregation in Cells”為題,于近日發(fā)表在《德國應用化學》(Angew. Chem. Int. Ed.)上。該工作的共同第一作者是大連化物所博士后萬旺和職工曾亮鋼。該工作得到了國家自然科學基金、遼寧省興遼人才計劃、大連市科創(chuàng)基金、博士后面上基金等項目的支持。